Выбор смеси при диетотерапии детей с аллергией к белкам коровьего молока

Новик Г.А., Жданова М.В., Зайцева Ю.О., Демидова А.С.
Аллергия к белкам коровьего молока (АБКМ) — одна из наиболее частых форм пищевой аллергии у детей раннего возраста, значительно опережающая по распространенности сенсибилизацию к яйцу и рыбе [1]. B.I. Nwaru и соавт. показали (метаанализ 42 эпидемиологических исследований), что АБКМ в течение жизни отмечают до 6% людей, при этом доля лиц, у которых аллергия была подтверждена оральной провокационной пробой, составила лишь 0,6% [2]. В более ранних работах доля детей в возрасте до 1 года с АБКМ оценивалась на уровне 2-3% [3]. Согласно результатам когортного исследования, проводившегося на о. Уайт (Великобритания) с 1989 г. на протяжении 18 лет, частота пищевой аллергии в раннем возрасте оставалась постоянной (5,3, 4,4 и 5%) на 1, 2 и 4-м годах жизни соответственно со значительным снижением к 10 годам жизни (2,3%) и затем снова возрастала, составляя около 4% к 18-летнему возрасту. При этом сенсибилизация к коровьему молоку (1,6-3,5%) и яйцу (1,1-1,4%) преобладала над другими аллергенами в первые 10 лет жизни [4]. Важно также отметить, что частота сенсибилизации к белку коровьего молока выше среди детей на искусственном вскармливании. Однако эпидемиологические данные в разных исследованиях различаются, поскольку зависят от тех диагностических методов, которые применяют для подтверждения АБКМ (использование только специфических IgE и/или прик-тестов, наличие или отсутствие провокационных тестов) [5].
В 2015 г. в исследовании EuroPrevall было обследовано 9336 детей в 9 европейских странах из разных климатических и этнокультурных регионов. На основании полученных данных была создана единая информационная база о случаях АБКМ [6]. В общей сложности в участвующие центры обратились 1928 родителей с жалобами на аллергические реакции у детей. Дополнительно в ходе регулярных опросов были выявлены еще 684 ребенка с признаками аллергической реакции. Из 1117 детей, приглашенных в центры для дальнейшего обследования с проведением оральной провокационной пробы, подошли 358 человек. В числе критериев включения были уровень специфических IgE к молоку ≥ 0,35 Ед/л, положительная проба по данным прик-теста (> 3 мм), симптомы, появляющиеся в течение 2 ч после употребления коровьего молока и/или повторяющиеся симптомы, которые исчезали при исключении коровьего молока из рациона ребенка. Из-за отказа родителей проба не была проведена у 110 детей и была положительной у 55/248 (22%). Таким образом, показатель заболеваемости АБКМ в первые два года жизни составил 0,54%, при этом превалировали IgE-ассоциированные формы заболевания. Однако у приведенного исследования имеется ряд ограничений. В частности, диагноз АБКМ устанавливали при выявлении ранних (менее 2 ч с момента проведения пробы), объективно верифицируемых признаков аллергии со стороны кожи, ЖКТ или дыхательной системы либо учитывали позднее (более 2 ч) обострение экземы. Напротив, субъективные симптомы аллергии (колики, нарушение поведения), появившиеся во время или после проведения оральной пробы, не учитывали, проба считалась отрицательной. Кроме того, оральная провокационная проба была проведена с большим интервалом от момента формирования первых симптомов, т.е. возможны случаи, когда некоторые дети с АБКМ к моменту проведения пробы уже выработали толерантность к белкам молока. S. Koletzko и R.G. Heine [7], комментируя результаты EuroPrevall, отметили, что не в полной мере была учтена гастроинтестинальная (IgE-независимая) форма АБКМ, что привело к искажению выводов исследования.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ АЛЛЕРГИИ К БЕЛКАМ КОРОВЬЕГО МОЛОКА
Действительно, истинную распространенность всех реакций на коровье молоко сложно оценить ввиду гетерогенности клинических проявлений и разных диагностических критериев, используемых в реальной клинической практике [6]. Симптомы и признаки АБКМ могут появиться уже в первые несколько месяцев жизни, часто в течение нескольких суток или недель после введения смеси на основе коровьего молока или при исключительно грудном вскармливании в случае употребления матерью продуктов на основе коровьего молока [8, 9]. Более того, спектр симптомов АБКМ неодинаков при IgE-зависимых и IgE-независимых механизмах развития заболевания (рис. 1). IgE-зависимые реакции возникают немедленно или в течение 2 ч после приема пищи, содержащей белки коровьего молока [8]. Эти реакции могут выражаться в виде симптомов со стороны кожи, ротоглотки, дыхательной, сердечно-сосудистой систем и ЖКТ. Выраженность симптомов может варьировать от легкого течения до анафилаксии. Очевидно, что диагностика АБКМ в таких случаях не представляет трудности. Напротив, в случаях с IgE-независимым механизмом установление диагноза АБКМ может быть затруднительным [9]. К IgE-независимым реакциям относят такие гастроинтестинальные проявления, как проктоколит, синдром энтероколита и энтеропатия, индуцированные пищевыми белками. Отдельно выделяют и смешанные (IgE-зависимые и клеточные) реакции, такие как атопический дерматит и эозинофильные поражения ЖКТ [10]. В частности, отмечено, что с употреблением коровьего молока связаны до трети случаев атопического дерматита среднетяжелого и тяжелого течения [8, 11]. Считается также, что у некоторых детей АБКМ с IgE-независимым механизмом может проявляться функциональными нарушениями со стороны ЖКТ (срыгивания, рвота, запор, плач, колики) (см. рис. 1) [5].
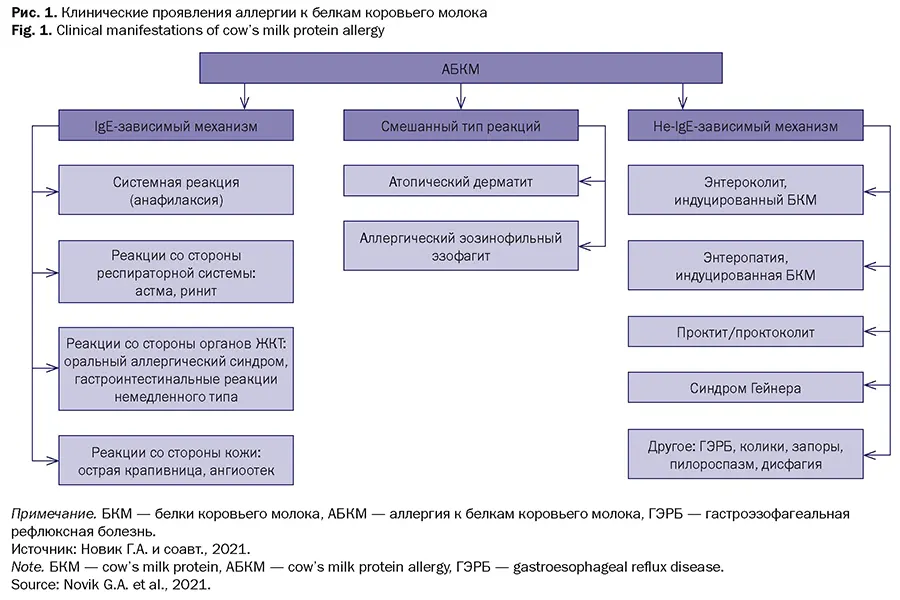
Для повышения осведомленности клиницистов о симптомах, которые могут быть связаны с АБКМ у детей раннего возраста, Y. Vandenplas и соавт. предложили диагностический инструмент — шкалу CoMiSS [12]. В ней учтены такие симптомы, как плач, срыгивания, изменения стула, кожи и респираторные симптомы, выраженность которых оценивается в баллах. Заподозрить АБКМ можно при общей сумме баллов > 12 (как правило, речь идет о тяжелых проявлениях со стороны двух систем или органов либо среднетяжелых проявлениях со стороны не менее чем трех систем). Тем не менее, постановка диагноза АБКМ — это достаточно сложная задача не только в связи с отсутствием патогномоничных симптомов, но и по причине отсутствия специфичных методов лабораторного подтверждения сенсибилизации для IgE-независимых форм заболевания [13].
Обязательным элементом диагностики АБКМ у детей как на искусственном, так и на естественном вскармливании является элиминационная диета длительностью 2-4 нед с последующим диагностическим введением продукта [14]. У детей на искусственном вскармливании при подозрении на АБКМ рекомендован перевод пациента на высокогидролизованные смеси (ВГС) или аминокислотные смеси — как при IgE-зависимых, так и при IgE-независимых формах [15, 16]. Стоит помнить о том, что возникновение симптомов после употребления продуктов говорит лишь о наличии причинно-следственной связи, но не обязательно о вовлечении в процесс иммунологических механизмов. Именно поэтому важной особенностью ведения пациентов с гиперчувствительностью к молоку является разделение понятий «аллергия» и «непереносимость» [17]. Аллергия — патологическая реакция, в основе которой лежат иммунные механизмы, в то время как непереносимость — неаллергическая реакция на пищу, связанная с недостаточностью ферментов, непереносимостью кофеина, глутамата, аминов, салицилатов и других пищевых добавок и консервантов [18, 19].
ОСНОВНЫЕ АЛЛЕРГЕНЫ КОРОВЬЕГО МОЛОКА
Коровье молоко состоит из двух основных белковых фракций — казеина и сыворотки, и любой из этих компонентов может вызвать сенсибилизацию. Казеин состоит из 4 основных протеинов (αs1-, αs2-, β- и κ-казеины), а также κ-казеинов (γ1, γ2 и γ3), полученных в результате гидролиза β-казеина. Сывороточная фракция содержит α-лактальбумин (α-Lac), β-лактоглобулин (β-Lg), бычий сывороточный альбумин, лактоферрин и иммуноглобулины. Казеин, α-лактальбумин и β-лактоглобулин считаются основными аллергенами, т.е. больше 50% пациентов с АБКМ сенсибилизированы к ним [20]. Некоторые пациенты сенсибилизированы только к минорным белкам, например к лактоферрину или к сывороточному альбумину, которые присутствуют в молоке в небольших концентрациях [20].
Иммунореактивные эпитопы и пептидные фрагменты β-лактоглобулинов и казеинов и их роль в формировании АБКМ были подробно изучены. Установлено, что в зависимости от аминокислотной последовательности эпитопы бывают линейными и конформационными. Для возникновения аллергической реакции необходимо, чтобы циркулирующие антитела распознали специфические эпитопы с дальнейшим каскадом иммунных реакций, приводящих к симптомам АБКМ. Знания об иммуногенности пептидов имеют фундаментальное значение как для врачей, так и для производителей детских смесей с целью подбора наиболее эффективной формулы.
ПРОИЗВОДСТВО ЛЕЧЕБНЫХ МОЛОЧНЫХ СМЕСЕЙ ДЛЯ ДЕТЕЙ С АЛЛЕРГИЕЙ К БЕЛКАМ КОРОВЬЕГО МОЛОКА
Молочные смеси, используемые для профилактики и лечения АБКМ, различаются по степени гидролиза, а также по технологии гидролиза делятся на частично-(ЧГС) и высокогидролизованные (ВГС). У детей с тяжелыми проявлениями АБКМ могут использоваться аминокислотные смеси, которые не содержат белков. Кроме того, смеси различаются по составу основного белка — делятся на казеиновые и сывороточные гидролизаты. ЧГС должны содержать олигопептиды с молекулярным весом < 5 кДа, ВГС — < 3 кДа; азотистый компонент аминокислотной смеси представлен заменимыми и незаменимыми аминокислотами [21].
Производство гидролизованных смесей в настоящее время включает 4 основных этапа:
- термическая обработка — в основном влияет на конформационные эпитопы сывороточных протеинов, снижая их аллергенность, но слабо воздействует на казеиновую фракцию [22];
- ферментативный гидролиз — расщепление полипептидных цепей с использованием трипсина, химотрипсина, папаина для разрушения линейных эпитопов; воздействует как на сывороточную, так и на казеиновую фракции [22, 23];
- ферментативный гидролиз под гидростатическим давлением — выработка еще более коротких цепей, чем при стандартном гидролизе [24];
- ультрафильтрация остаточных длинных пептидов [22].
Молекулярная основа изменения аллергенности при ферментативном гидролизе состоит в инактивации или разрушении пептидных связей таким образом, чтобы не происходило распознавания эпитопов. Вместе с тем при производстве ВГС могут быть получены новые эпитопы или же появиться доступ к скрытым эпитопам. Одним из примеров служит реакция Майяра, когда при производстве смеси при высоких температурах происходит образование конечных продуктов гликирования из аминокислот и сахаров [25]. Реакция Майяра изменяет структуру и электростатические свойства протеинов, включая аллергены, путем гликирования. Это может снижать, усиливать или не изменять иммуногенность и аллергенность протеинов — в настоящее время не существует универсального способа предсказать влияние реакции Майяра. Кроме того, согласно данным последних исследований, продукты реакции Майяра, в особенности продукты продвинутого гликирования, содержащиеся в диете, могут быть вовлечены в процесс хронического воспаления и воздействовать на микробиом кишечника, усиливая рост патогенных бактерий и/или представителей нормальной микробиоты (например, бифидо- и лактобактерий) [26].
ОСТАТОЧНАЯ АЛЛЕРГЕННОСТЬ: ВАЖНОСТЬ РАЗМЕРА ПЕПТИДОВ В СМЕСИ
Аллергические свойства ВГС можно охарактеризовать посредством спектра размеров пептидов (молекулярная масса) и содержания азотистых соединений. Аллергенные свойства могут быть проверены in vitro с помощью различных иммунологических методик, включая IgE-связывающие тесты, такие как радиоаллергосорбент-тест (RAST), тест на ингибирование RAST или иммуноферментный анализ (ELISA), а также in vivo при помощи скарификационной кожной пробы и «золотого стандарта» — орального провокационного теста [27]. Для перекрестного связывания Fcs-рецептора с IgE необходимо, чтобы аллерген содержал как минимум два IgE-связывающих эпитопа с размером как минимум в 25 аминокислот [28]. Это означает, что пептиды размером < 3 кДа не способны вызвать аллергическую реакцию [29]. Ниже приведены результаты исследований, которые объясняют причины остаточной аллергенности некоторых ВГС.
M.E. Levin и соавт. (2017) оценили несколько ВГС и смесей на основе аминокислот на предмет их аллергенности, профиля размера пептидов и содержания аминокислот. Было показано, что все смеси схожи по составу, и не было получено данных in vitro об их остаточной аллергенности, однако был выявлен большой разброс значений пептидных соединений в пределах 1,5-3 кДа в различных смесях [30].
H. Hochwallner и соавт. обнаружили различия в иммуногенности пептидов различных ВГС и аминокислотных смесей [31]. Для анализа было выбрано 8 смесей, используемых для профилактики и лечения АБКМ: молочная смесь с немодифицированным белком, гипоаллергенные смеси, ВГС на основе сывороточных и казеиновых белков и аминокислотная смесь. Две ЧГС и две ВГС показали остаточную IgE-реактивность в реакции активации базофилов. Иммунореактивные α-лактальбумин и β-лактоглобулин были обнаружены в двух ЧГС. Помимо этого, в ВГС на основе сывороточного белка был обнаружен казеин, что может объяснять остаточную реактивность IgE и аллергенность смеси. Также была изучена способность изучаемых смесей вызывать пролиферацию Т-клеток. Две из четырех ВГС не показали остаточной реактивной способности Т-клеток и не индуцировали высвобождение провоспалительных цитокинов, при этом ЧГС индуцировали пролиферацию в той же степени, что и смеси на основе цельного белка. Полученные данные могут объяснять клиническую эффективность или неэффективность при использовании различных смесей для лечения и профилактики АБКМ, исходя из их иммунологических свойств [31].
T.T. Lambers и соавт. (2015) показали, что в некоторых смесях на основе казеина присутствуют различные фракции сывороточных белков, а в смесях на основе сывороточного белка — казеиновые фракции. Это можно объяснить тем фактом, что многие промышленные источники казеина содержат небольшие количества сывороточного белка (и наоборот), которые в конечном итоге могут быть выделены в их гидролизатах с помощью протеомных технологий [32].
S. Nutten и соавт. изучили иммуногенность пептидов 76 ВГС на основе сывороточного и казеинового белков 9 производителей [32]. Образцы продуктов были закодированы для слепого исследования. Анализ распределения пептидов по размеру проводили путем жидкостной хроматографии высокого давления одновременно в двух независимых лабораториях. В качестве маркера потенциальной аллергенности было выбрано произвольное пороговое значение в 1200 Да (эквивалентно молекулярной массе пептида, состоящего из 10-12 аминокислот). Показано, что 89-100% пептидов в ВГС имели молекулярную массу < 2400 Да. Было выделено три кластера иммуногенных пептидов с молекулярной массой > 1200 Да. В 1-й группе 5% иммуногенных пептидов с молекулярной массой > 1200 Да, полученных из казеина и β-лактоглобулина, были количественно определены с помощью высокочувствительного метода ELISA. Кроме того, подмножество из 9 ВГС с процентным содержанием пептидов с молекулярной массой > 1200 Да оценивали на предмет остаточной аллергенности β-лактоглобулина in vitro, используя метод дегрануляции. Были установлены существенные различия между образцами различных производителей. В продуктах некоторых производителей присутствовало значительное количество иммуногенных пептидов, в группу таких производителей попали даже те, у которых менее 3% пептидов превышали размер 1200 Да. Образцы Alfare и Alfare Allergy показали наивысшую степень расщепления белка и наименьшую иммуногенность по сравнению с другими ВГС (рис. 2) [33].
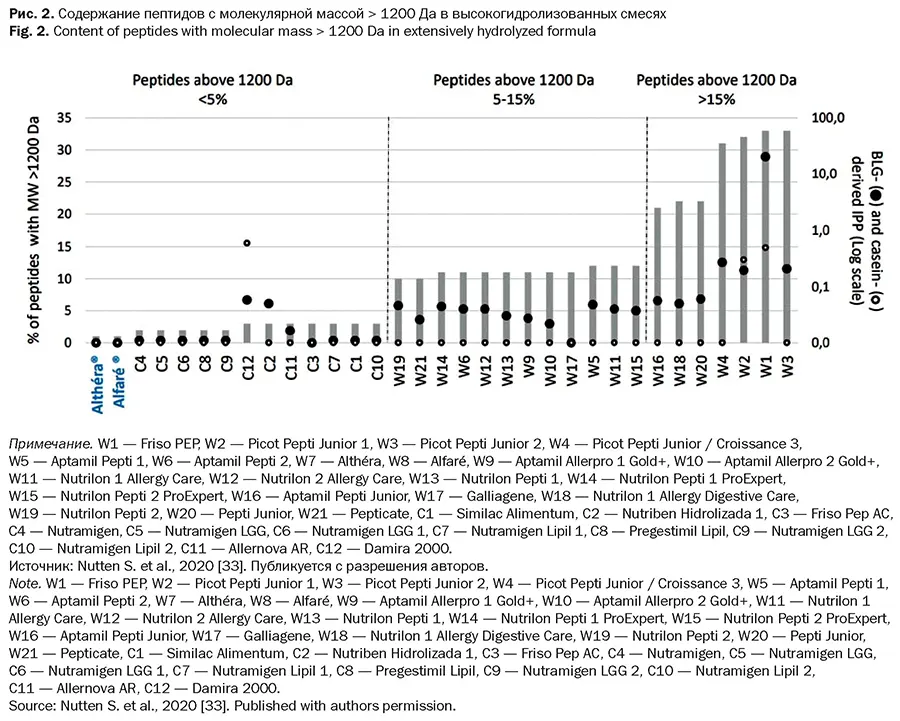
ТРЕБОВАНИЯ К ВЫСОКОГИДРОЛИЗОВАННЫМ СМЕСЯМ
Термин «гипоаллергенная смесь» впервые употреблен R.E. Kleiman и соавт. (1992) для характеристики смесей, которые переносят 90% пациентов с доказанной АБКМ. Этот термин в дальнейшем был адаптирован экспертами Всемирной организации здравоохранения [30]. На территории Российской Федерации термин «гипоаллергенная смесь» используется для обозначения ЧГС, которые могут применяться только для профилактики, но не для лечения пациентов с АБКМ. В 1999 г. Европейская ассоциация детской аллергологии и иммунологии заявила, что детские смеси, содержащие < 1% иммунореактивного белка от общего количества азотсодержащих веществ, могут маркироваться как смеси с пониженной аллергенностью [34]. В 2000 г. Американская академия педиатрии определила, что ВГС должны содержать только пептиды с молекулярной массой < 3 кДа, при этом большинство свободных пептидов должны быть < 1,5 кДа. В 2008 г. Американская академия педиатрии дополнила определение ЧГС как смесей, которые содержат олигопептиды с молекулярным весом < 5 кДа, ВГС — только пептиды с молекулярным весом < 3 кДа и аминокислотных смесей — как содержащих только свободные аминокислоты [35]. В 2014 г. Европейской организацией по обеспечению безопасности пищевых продуктов также было заявлено, что гидролизованные смеси недостаточно охарактеризованы по составу протеина, поэтому требуются дополнительные клинические исследования в целевой группе детей, для того чтобы получить новые данные о безопасности и эффективности каждой смеси [36]. Согласно требованиям многих профессиональных ассоциаций аллергологов и гастроэнтерологов (EAACI [37], ESPGHAN [5], ASCIA [38]), ЧГС не могут быть использованы у детей с симптомами АБКМ, т.к. эти смеси предназначены для детей, находящихся на искусственном вскармливании, для профилактики развития аллергических заболеваний, но не для их лечения.
ВЕДЕНИЕ ДЕТЕЙ С АЛЛЕРГИЕЙ К БЕЛКУ КОРОВЬЕГО МОЛОКА
Диетотерапия АБКМ — это полное исключение из рациона коровьего молока и содержащих его продуктов. Ранее было показано, что белок коровьего молока β-лактоглобулин может быть обнаружен в грудном молоке у большинства кормящих женщин даже после его ферментации в ЖКТ [39]. Вместе с тем в 2020 г. D. Munblit и соавт. опубликовали результаты исследования, согласно которым грудное молоко женщины, которая употребляет коровье молоко, содержит недостаточно белка, чтобы вызвать аллергическую реакцию у 99% младенцев с предполагаемой АБКМ [40]. Авторы использовали данные метаанализа исследований количественного определения β-лактоглобулина коровьего молока в грудном молоке и сравнили их с опубликованными данными порога реактивности при IgE-зависимом АБКМ. Количество белка, которое вызывает реактивность у 1% населения, для коровьего молока составляет 0,1 мг [41]. Концентрация β-лактоглобулина в грудном молоке у женщин широко варьировала, но чаще не определялась либо не достигала порогового значения (0,1 мг, или 5,6 нг/мл, β-лактоглобулина в 216 мл грудного молока), при котором 1% младенцев с АБКМ отреагируют на его наличие. Самый высокий медианный уровень концентрации β-лактоглобулина в грудном молоке в исследованиях составил 4,2 нг/мл, что в 1 млн раз ниже, чем уровень этого белка в коровьем молоке [40].
Однако клиническая реакция на белок коровьего молока будет зависеть не только от его количества, но и от характеристик IgE, образующихся в ходе аллергической реакции. Так, опубликованы данные, согласно которым ключевую роль в регуляции продукции IgE играет пул Tfh-клеток (T follicular helper) [42]. Tfh-клетки стимулируют выработку высокоаффинных IgE — индукторов последующей индуцированной аллергеном анафилаксии [43]. По мнению экспертов Европейской академии аллергии и клинической иммунологии (EAACI) и согласно положениям консенсуса [17], матерям детей, находящихся на грудном вскармливании, при выявлении у последних АБКМ необходимо назначить безмолочную диету с исключением молока и всех молочных продуктов. Такой подход к диетотерапии детей на грудном вскармливании с АБКМ, по-видимому, связан с тем, что клинически значимая реакция возможна даже на следовые количества белка [37].
При появлении симптомов АБКМ у детей, находящихся на смешанном или искусственном вскармливании с использованием смеси на основе немодифицированного молочного белка, рекомендована замена смеси. В настоящее время в качестве альтернативы молочным смесям существуют аминокислотные или полностью гидролизованные смеси на основе коровьего молока и на основе растительных белков (рисовые гидролизаты и смеси на основе сои). Смеси на основе молока других млекопитающих (козье, овечье), согласно актуальным отечественным [44] и международным [37, 38] рекомендациям, не показаны для лечения детей с АБКМ.
СМЕСИ НА ОСНОВЕ СОИ
Формулы на основе сои являются полноценными заменителями питательных веществ, однако не имеют преимуществ перед смесями на основе коровьего молока [45, 46]. Нативный соевый белок имеет более низкую биодоступность [47], а также более низкое содержание незаменимой аминокислоты метионина, чем белок коровьего молока, и карнитина, который синтезируется из метионина и участвует в метаболизме жирных кислот. В связи с этим рекомендуется дополнительное обогащение данных смесей метионином [48, 49]. Однако остаются проблемы с развитием аллергии на сою и с риском развития аллергии к арахису. Сопутствующая аллергия на соевый белок встречается у 1 из 10 младенцев с АБКМ [50].
Также актуален вопрос о воздействии фитоэстрогенов сои на младенцев мужского пола. Фитоэстрогены — это природные эстрогены растительного происхождения, обладающие слабой эстрогенной активностью. Главными фитоэстрогенами в сое являются изофлавоноиды, концентрация которых в соевых смесях превышает таковую в коровьем молоке в 10 тыс. раз [47]. Фитоэстрогены в высоких дозах имеют негативное влияние на развитие репродуктивной системы у животных, но нет никаких доказательств подобного влияния у людей [51]. В систематическом обзоре работ, посвященных влиянию сои на раннее половое развитие, не было получено подтверждений негативных гормональных эффектов сои [52]. T. Sinai и соавт. также подтвердили отсутствие связи между использованием смесей на основе сои в раннем возрасте и влиянием на рост и раннее половое развитие в последующем [53]. В связи с наличием противоречивых данных в качестве меры предосторожности Европейское гастроэнтерологическое сообщество (ESPGHAN) рекомендовало не использовать соевые смеси как единственный источник питания у детей в возрасте до 6 мес [51]. Требуются дополнительные исследования по изучению влияния фитоэстрогенов сои в раннем возрасте.
ВЫСОКОГИДРОЛИЗОВАННЫЕ СМЕСИ
ВГС для лечения детей с АБКМ могут различаться по следующим характеристикам: источник белка (казеиновый или сывороточный гидролизат), размер пептидов и вкусовые качества. Вкусовые характеристики зависят как от источника белка, так и от степени его гидролиза [54]. Известно, например, что смеси на основе казеинового гидролизата отличаются от таковых на сывороточных гидролизатах более горьким вкусом [54].
В нескольких исследованиях было установлено, что при IgE-зависимом механизме АБКМ отсутствие клинически значимого эффекта имеет место примерно у 10% детей, получающих ВГС. При этом при IgE-независимом механизме отсутствие или неполный эффект наблюдаются почти у 30% детей [55]. D. de Boissieu и соавт. на примере 16 детей, получавших ВГС, отметили отсутствие положительной динамики симптомов атопического дерматита и купирования гастроинтестинальных симптомов, тогда как при переходе на аминокислотную смесь симптомы купировались и возвращались при повторном использовании ВГС [56]. В том случае, когда ребенка переводят на ВГС, но не наблюдается положительной динамики (исчезновения клинических симптомов АБКМ) в течение 2-4 нед, в первую очередь должна быть рассмотрена аллергическая реакция на остаточные пептиды, в особенности у детей с множественной аллергией. Отсутствие эффекта от использования ВГС может быть связано с наличием остаточной аллергенности за счет крупных пептидов или даже цельных белков в результате неполного гидролиза нативного белка коровьего молока [27, 57]. Согласно современным рекомендациям, в таких случаях с диагностической целью целесообразно применение аминокислотной смеси, в которой отсутствуют пептиды, на протяжении 2-4 нед [5]. Аминокислотные смеси могут быть использованы в качестве терапии первой линии в лечении детей с АБКМ, однако ввиду их высокой стоимости применяются в первую очередь у детей с тяжелыми проявлениями АБКМ, в т.ч. с анафилаксией, множественной пищевой аллергией, с тяжелым неконтролируемым течением атопического дерматита, с тяжелыми формами IgE-независимого течения АБКМ (эозинофильный эзофагит, энтероколитический синдром), помимо этого — при отставании в физическом развитии и неэффективности ВГС.
Все актуальные на настоящий момент руководства предлагают использовать в лечении АБКМ у детей ВГС или аминокислотные смеси, но не ЧГС (таблица). Согласно российским клиническим рекомендациям по ведению детей с АБКМ, при легком и среднетяжелом течении вводят ВГС, при тяжелом течении — аминокислотные смеси [44]. Срок элиминации белков коровьего молока составляет не менее 6 мес или до возраста одного года, при тяжелом течении — увеличивается до 12-18 мес [44]. При развитии симптомов аллергии после диагностического введения смеси на основе белков коровьего молока срок элиминации может быть продлен еще на > 6 мес до формирования толерантности [44]. В опубликованном Y. Vandenplas и соавт. руководстве был предложен подход к диетотерапии АБКМ, при котором ЧГС и ВГС рекомендуется использовать для проведения провокационной пробы и решения вопроса о выборе ВГС или аминокислотной смеси для дальнейшего лечения [15]. На этапе расширения диеты следует провести пробу с ЧГС, а не с цельным белком коровьего молока. В случае развития симптомов ребенка переводят на ВГС с оценкой симптомов и при необходимости возвращаются к аминокислотной смеси [15].
Таблица
Выбор смеси у детей с аллергией к белкам коровьего молока / The choice of formula in children with cow’s milk protein allergy
Клинические признаки | IMAP (1-я линия) [58] | BSACI (1-я линия) [47] | DRACMA (1-я линия) [17] | ESFGAN (1-я линия) [1] |
Анафилаксия | АС | АС | АС | АС |
Острая крапивница / ангиоотек | ВГС | ВГС | ВГС | ВГС |
Атопический дерматит | ВГС | ВГС/АС | ВГС | ВГС |
ЭоЭ | Нет данных | АС | АС | АС* |
ГЭР | ВГС | ВГС | ВГС | ВГС |
Белок-индуцированная энтеропатия | ВГС | ВГС/АС | ВГС | АС |
FPIES | АС | АС | ВГС | АС |
Проктоколит | ВГС | ВГС | ВГС | ВГС |
Примечание. АС — аминокислотная смесь, ВГС — высокогидролизованная смесь, ЭоЭ — эозинофильный эзофагит, ГЭР — гастроэзофагеальный рефлюкс, ГЭРБ — гастроэзофагеальная рефлюксная болезнь, FPIES — энтероколитический синдром. IMAP (International Milk Allergy in Primary Care, 2019) — руководство по ведению пациентов легкого и умеренного IgE-независимого АБКМ. BSACI (Британское сообщество аллергологии и клинической иммунологии, 2014) — руководство по диагностике и ведению пациентов с АБКМ. DRACMA (Diagnosis and Rationale for Action against Cow’s Milk Allergy, 2010) — рекомендации по диагностике и лечению пациентов с АБКМ. ESPGHAN (Европейское сообщество гастроэнтерологии, гепатологии и питания, 2012) — диагностика и лечение детей с АБКМ. <*> — для пациентов с ГЭРБ.
Источник: Новик Г.А. и соавт., 2021.
Note. АС — amino acid formula, ВГС — extensively hydrolyzed formula, ЭоЭ — eosinophilic esophagitis, ГЭР — gastroesophageal reflux, ГЭРБ — gastroesophageal reflux disease, FPIES — food protein induced enterocolitis syndrome. IMAP (International Milk Allergy in Primary Care, 2019) — the guidelines for the management of patients with mild and moderate IgE-independent CMPA. BSACI (British Society for Allergy and Clinical Immunology, 2014) — the guidelines on diagnosis and management of patients with cow’s milk protein allergy. DRACMA (Diagnosis and Rationale for Action against Cow’s Milk Allergy, 2010) — the guidelines on diagnosis and management of patients with cow’s milk protein allergy. ESPGHAN (European Society for Paediatric Gastroenterology, Hepatology and Nutrition, 2012) — diagnosis and management of children with cow’s milk protein allergy. <*> — for patients with gastroesophageal reflux disease.
Source: Novik G.A. et al., 2021.
Говоря о преимуществах применения ВГС при лечении детей с АБКМ необходимо упомянуть и о сроках формирования толерантности при использовании различных смесей [59]. Большинство детей формируют толерантность к АБКМ к 3-летнему возрасту, но у некоторых она может формироваться и позднее [60]. He-IgE-опосредованная аллергия проходит раньше, чем IgE-зависимая [60]. В проспективном исследовании вопроса приобретения толерантности с участием 260 детей с АБКМ (IgE-ассоциированная в 43% случаев) было показано, что толерантность через 12 мес лечения сформировалась у большей доли детей, получавших ВГС (43,6%) или ВГС + лактобактерии (78,9%), в сравнении с детьми, получавшими рисовые (32,6%), соевые (23,6%) и аминокислотные смеси (18,2%) [61].
КАК ВЫБРАТЬ СМЕСЬ?
В первую очередь стоит опираться на российские и международные рекомендации относительно первой линии ВГС или аминокислотной смеси при различных проявлениях АБКМ у детей. Для детей с АБКМ, находящихся на искусственном вскармливании, согласно рекомендациям EAACI (2014), в первую очередь показаны смеси с высокой степенью гидролиза. Аминокислотные смеси также могут быть применимы для подгруппы пациентов с более тяжелыми симптомами аллергии.
При выборе ВГС в качестве терапии первой линии стоит помнить о том, что все ВГС, на основе как сывороточного, так и казеинового белка с различной длиной пептидов (все с большей частью < 3 кДа), должны соответствовать современным требованиям, предъявляемым к высокогидролизованным смесям. При отсутствии положительной динамики на ВГС в первую очередь должна быть рассмотрена аллергическая реакция на остаточные пептиды из-за неполного гидролиза белка или наличия крупных пептидов, не удаленных после ультрафильтрации в процессе приготовления смеси. Помимо белкового компонента, необходимо учитывать и небелковый профиль каждой отдельной смеси, исходя из индивидуальных особенностей конкретного ребенка.
Для достижения эффекта у детей с гастроинтестинальными проявлениями АБКМ рекомендуют смеси с низким содержанием лактозы и увеличенным процентом среднецепочечных жирных кислот [62]. При этом полное исключение лактозы из рациона ребенка неблагоприятно для развития здоровой кишечной микробиоты и приводит к снижению абсорбции кальция [63]. Смеси, обогащенные среднецепочечными жирными кислотами, показаны при гастроинтестинальных проявлениях пищевой аллергии, т.к. могут прямо реабсорбироваться через слизистую оболочку ЖКТ. Клинические симптомы энтеропатии включают в себя хроническую диарею, нарушение роста, плохой аппетит. Мальабсорбция ведет к анемии, гипо-альбуминемии и другим дефицитам. В этом случае смесь, обогащенная среднецепочечными жирными кислотами, на начальных этапах может повлиять на эффективность терапии этого состояния [64].
Наличие дополнительных минералов и витаминов также имеет большое значение при выборе смеси. Ведущую роль в развитии ребенка играют следующие витаминноминеральные комплексы. Холин (витамин В4) — компонент фосфолипидов мембран, из которого синтезируется ацетилхолин, действует как липотропный и гепатопротекторный фактор [65]. Инозитол — витаминоподобное вещество (витамин В8), представляет собой изомер глюкозы, необходимый для функционирования головного мозга [66]. Нуклеотиды играют ключевую роль в энергообмене и передаче генетических данных, влияют на становление иммунной системы, на рост и массу тела [67]. Немаловажным является и добавление витамина D в смеси для лечения АБКМ, поскольку известно, что дефицит витамина D среди прочих факторов может способствовать развитию сенсибилизации [68].
Существующие на настоящий момент данные относительно использования пре- и пробиотиков трудно интерпретировать, т.к. зачастую они противоречат друг другу [69].
Согласно результатам последнего метаанализа, пребиотики влияют на долгосрочное снижение заболеваемости атопическим дерматитом. Сапплементация преи пробиотиками может быть полезной в предотвращении тяжелого течения атопического дерматита [70]. Согласно последнему консенсусу EAACI (2021), в настоящее время нет рекомендацией ни за, ни против использования пребиотиков для профилактики аллергии [37]. Требуется проведение дальнейших исследований, подтверждающих важность пре- и пробиотических составляющих в высокогидролизованных и аминокислотных смесях.
Определяющим, но не единственным фактором при выборе ВГС для вскармливания детей с АБКМ остается размер пептидов. Чем больше процент низкомолекулярных пептидов с молекулярной массой < 1200 Да в смеси, тем ниже вероятность развития аллергической реакции. Именно поэтому предпочтение следует отдавать смесям, которые содержат преимущественно пептиды с низкой молекулярной массой, в связи с отсутствием иммуногенности. Наиболее значимым критерием выбора остается клиническая эффективность смеси у конкретного ребенка.
ЗАКЛЮЧЕНИЕ
В последние десятилетия повсеместно наблюдается повышение частоты аллергических заболеваний, в т.ч. и пищевой аллергии. Ввиду этого приоритетом является поиск эффективных средств для их предотвращения и лечения. Своевременная диагностика АБКМ необходима для назначения оптимальной диеты и, как следствие, поддержки нормального роста и развития младенцев. В актуальных национальных и международных руководствах по диагностике и ведению пациентов с АБКМ ключевым является подбор подходящей смеси для искусственного вскармливания. В качестве лечебных у детей с АБКМ используют высокогидролизованные и аминокислотные смеси. Их выбор, как правило, обусловлен тяжестью клинических проявлений АБКМ, а также переносимостью и доступностью смесей. Особое внимание уделяется важности размера пептидов белка коровьего молока в гидролизованных смесях, их остаточной аллергенности и клинической реактивности у ребенка.
СПИСОК ЛИТЕРАТУРЫ / REFERENCES
- Mahesh PA, Wong GWK, Ogorodova L, et al. Prevalence of food sensitization and probable food allergy among adults in India: the EuroPrevall INCO study. Allergy. 2016;71(7):1010-1019. doi: 10.1111/all.12868
- Nwaru BI, Hickstein L, Panesar SS, et al: Prevalence of common food allergies in Europe: a systematic review and meta-analysis. Allergy. 2014;69(8):992-1007. doi: 10.1111/all.12423
- Host A. Frequency of cow’s milk allergy in childhood. Ann Allergy Asthma Immunol. 2002;89(6 Suppl 1): 33-37. doi: 10.1016/ s1081-1206(10)62120-5
- Venkataraman D, Erlewyn-Lajeunesse M, Kurukulaaratchy RJ, et al. Prevalence and longitudinal trends of food allergy during childhood and adolescence: results of the Isle of Wight Birth Cohort study. Clin Exp Allergy. 2018;48(4):394-402. doi: 10.1111/cea.13088
- Koletzko S, Niggemann B, Arato A, et al: Diagnostic approach and management of cow’s milk protein allergy in infants and children: ESPGHAN GI Committee practical guidelines. J Pediatr Gastroenterol Nutr. 2012;55(2):221-229. doi: 10.1097/ MPG.0b013e31825c9482
- Shoemaker AA, Sprikkelman AB, Grimshaw KE, et al. EuroPrevall birth cohort. Allergy. 2015;70(8):963-972. doi: 10.1111/all.12630.
- Koletzko S, Heine RG. Non-IgE mediated cow’s milk allergy in EuroPrevall. Allergy. 2015;70(12):1679-1680. doi: 10.1111/all.12681
- Host A. Cow’s milk protein allergy and intolerance in infancy. Some clinical, epidemiological and immunological aspects. Pediatr Allergy Immunol. 1994;5(5 Suppl):1-36.
- Heine RG, Elsayed S, Hosking CS, Hill DJ. Cow’s milk allergy in infancy. Curr Opin Allergy Clin Immunol. 2002;2(3):217-225. doi: 10.1097/00130832-200206000-00011
- Jarvinen KM, Chatchatee P. Mammalian milk allergy: clinical suspicion, cross-reactivities and diagnosis. Curr Opin Allergy Clin Immunol. 2009;9(3):251-258. doi: 10.1097/ACI.0b013e32832b3f33
- Lifschitz C, Szajewska H. Cow’s milk allergy: evidence-based diagnosis and management for the practitioner. Eur J Pediatr. 2015; 174(2):141-150. doi: 10.1007/s00431-014-2422-3
- Vandenplas Y, Dupont C, Eigenmann P, et al. A workshop report on the development of the Cow’s Milk-related Symptom Score awareness tool for young children. Acta Paediatr. 2015;104(4):334-339. doi: 10.1111/apa.12902
- Soares-Weiser K, Takwoingi Y, Panesar SS, et al. The diagnosis of food allergy: a systematic review and meta-analysis. Allergy. 2014;69(1):76-86. doi: 10.1111/all.12333
- Намазова-Баранова Л.С., Макарова С.Г., Вишнёва Е.А. и др. Актуальные вопросы диагностики пищевой аллергии в педиатрической практике // Вестник Российской академии медицинских наук. — 2015. — Т. 70. — № 1. — C. 41-46. [Namazova-Baranova LS, Makarova SG, Vishneva EA, et al. Topical Issues of Food Allergy Diagnosis in Pediatric Practice. Vestnik Rossiiskoi Akademii Meditsinskikh Nauk — Annals of the Russian academy of medical sciences. 2015;70(1):41-46. (In Russ).] doi: 10.15690/ vramn.v70i1.1230
- Vandenplas Y, Al-Hussaini B, Al-Mannaei K, et al. Prevention of Allergic Sensitization and Treatment of Cow’s Milk Protein Allergy in Early Life: The Middle-East Step-Down Consensus. Nutrients. 2019; 11(7):1444. doi: 10.3390/nu11071444
- Dupont C, Chouraqui JP, de Boissieu D, et al. Committee on Nutrition of the French Society of Pediatrics: dietary treatment of cow’s milk protein allergy in childhood. Br J Nutr. 2012;107(3): 325-338. doi: 10.1017/S0007114511004831
- Fiocchi A, Brozek J, Schunemann H, et al. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow’s Milk Allergy (DRACMA) Guidelines. World Allergy Organ J. 2010;3(4):57-161. doi: 10.1097/WOX.0b013e3181defeb9
- Dreborg S. Debates in allergy medicine: food intolerance does not exist. World Allergy Organ J. 2015;8:37. doi: 10.1186/ s40413-015-0088-6
- Lin CH. Food allergy: what it is and what it is not? Curr Opin Gastroenterol. 2019;35(2):114-118. doi: 10.1097/ MOG.0000000000000506
- Tsabouri S, Douros K, Priftis KN. Cow’s milk allergenicity. Endocr Metab Immune Disord Drug Targets. 2014;14(1):16-26. doi: 10.2174/1871530314666140121144224
- Vandenplas Y, Bhatia J, Shamir R, et al. Hydrolyzed formulas for allergy prevention. J Pediatr Gastroenterol Nutr. 2014;58(5): 549-552. doi: 10.1097/MPG.0000000000000318
- Siemensma AD et al. The importance of peptide lengths in hypoallergenic infant formulae. Trends of Food Science & Technology. 1993;41(1):16-21.
- Wang J, Su Y, Jia F, Jin H. Characterization of casein hydrolysates derived from enzymatic hydrolysis. Chem Cent J. 2013;7(1):62. doi: 10.1186/1752-153X-7-62
- Chicon R, Belloque J, Alonso E, et al. Hydrolysis under high hydrostatic pressure as a means to reduce the binding of beta-lac-toglobulin to immunoglobulin E from human sera. J Food Prot. 2008; 71(7):1453-1459. doi: 10.4315/0362-028x-71.7.1453
- Aalaei K, Sjoholm I, Rayner M, et al. Early and advanced stages of Maillard reaction in infant formulas: Analysis of available lysine and carboxymethyl-lysine. PLoS One. 2019;14(7):e0220138. doi: 10.1371/journal.pone.0220138
- Toda M, Hellwig M, Henle T, Vieths S. Influence of the Maillard Reaction on the Allergenicity of Food Proteins and the Development of Allergic Inflammation. Curr Allergy Asthma Rep. 2019;19(1):4. doi: 10.1007/s11882-019-0834-x
- Rosendal A, Barkholt V. Detection of potentially allergenic material in 12 hydrolyzed milk formulas. J Dairy Sci. 2000;83(10): 2200-2210. doi: 10.3168/jds.S0022-0302(00)75103-4
- Meulenbroek LAPM, den Hartog Jager CF, Lebens AFM, et al. Characterization of T cell epitopes in bovine a-lactalbumin. Int Arch Allergy Immunol. 2014;163(4):292-296. doi: 10.1159/000360733
- Huby RDJ, Dearman RJ, Kimber I. Why are some proteins allergens? Toxicol Sci. 2000;55(2):235-246. doi: 10.1093/ toxsci/55.2.235
- Levin ME, Blackhurst DM, Kirstein F. Residual allergenicity of amino acid-based and extensively hydrolysed cow’s milk formulas. S Afr Med J. 2017;107(9):763-767. doi: 10.7196/SAMJ.2017. v107i9.12137
- Hochwallner H, Schulmeister U, SwobodaI, et al. Infant milk formulas differ regarding their allergenic activity and induction of T-cell and cytokine responses. Allergy. 2017;72(3):416-424. doi: 10.1111/all.12992
- Lambers TT, Gloerich J, van Hoffen E, et al. Clustering analyses in peptidomics revealed that peptide profiles of infant formulae are descriptive. Food Sci Nutr. 2015;3(1):81-90. doi: 10.1002/ fsn3.196
- Nutten S, Maynard F, Jarvi A, et al. Peptide size profile and residual immunogenic milk protein or peptide content in extensively hydrolyzed infant formulas. Allergy. 2020;75(6):1446-1449. doi: 10.1111/all.14098
- Host A, Koletzko B, Dreborg S, et al. Dietary products used in infants for treatment and prevention of food allergy. Joint Statement of the European Society for Paediatric Allergology and Clinical Immunology (ESPACI) Committee on Hypoallergenic Formulas and the European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) Committee on Nutrition. Arch Dis Child. 1999;81(1):80-84. doi: 10.1136/adc.81.1.80
- Greer FR, Sicherer SH, Burks AW. Effects of early nutritional interventions on the development of atopic disease in infants and children: the role of maternal dietary restriction, breastfeeding, timing of introduction of complementary foods and hydrolyzed formulas. Pediatrics. 2008;121(1):183-192. doi: 10.1542/ peds.2007-3022
- Scientific Opinion on the essential composition of infant and follow-on formulae. EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA). EFSA J. 2014;12(7):3760. doi: 10.2903/ j.efsa.2014.3760
- Halken S, Muraro A, de Silva D, et al. European Academy of Allergy and Clinical Immunology Food Allergy and Anaphylaxis Guidelines Group. EAACI guideline: preventing the development of food allergy in infants and young children (2020 update). Pediatr Allergy Immunol. 2021;32(5):843-858. doi: 10.1111/pai.13496
- Australasian Society of Clinical Immunology and Allergy. Infant feeding and allergy prevention: ASCIA guidelines. Sydney: ASCIA; 2020. Available online: https://www.allergy.org.au/images/pcc/ASCIA_ Guidelines_Infant_Feeding_and_Allergy_Prevention_2020.pdf. Accessed on July 3, 2021.
- Linhart B, Freidl R, Elisyutina O, et al. Molecular Approaches for Diagnosis, Therapy and Prevention of Cow’s Milk Allergy. Nutrients. 2019;11(7):1492. doi: 10.3390/nu11071492
- Munblit D, Perkin MR, Palmer DJ, et al. Assessment of Evidence About Common Infant Symptoms and Cow’s Milk Allergy. JAMA Pediat. 2020;174(6):599-608. doi: 10.1001/jamapediatrics.2020.0153
- Allen KJ, Remington BC, Baumert JL, et al. Allergen reference doses for precautionary labeling (VITAL 2.0): clinical implications. J Allergy Clin Immunol. 2014;133(1):156-164. doi: 10.1016/ j.jaci.2013.06.042
- Kobayashi T, Iijima K, Dent AL, Kita H. Follicular Helper T Cells Mediate IgE Antibody Response to Airborne Allergens. J Allergy Clin Immunol. 2017;139(1):300-313.e7. doi: 10.1016/ j.jaci.2016.04.021
- Gowthaman U, Chen JS, Zhang B, et al. Identification of a T follicular helper cell subset that drives anaphylactic IgE. Science. 2019; 365(6456):eaaw6433. doi: 10.1126/science.aaw6433
- Баранов А.А., Намазова-Баранова Л.С., Хаитов Р.М. и др. Пищевая аллергия у детей: методическое руководство / Союз педиатров России. — М.: ПедиатрЪ; 2021. — 76 с. [Baranov AA, Namazova-Baranova LS, Haitov RM, et al. Pishchevaya allergiya u detei: Methodological guide. The Union of Pediatricians of Russia. Moscow: Pediatr; 2021. 76 p. (In Russ).]
- Badger TM, Gilchrist JM, Pivik RT, et al. The health implications of soy infant formula. Am J Clin Nutr. 2009;89(5):1668S-1672S. doi: 10.3945/ajcn.2009.26736U
- ESPGHAN Committee on Nutrition. Soy protein infant formulae and follow-on formulae: A commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2006;42(4):352-361. doi: 10.1097/01.mpg.0000189358.38427.cd
- Luyt D, Ball H, Makwana N, et al. Standards of Care Committee (SOCC) of the British Society for Allergy and Clinical Immunology (BSACI). BSACI guideline for the diagnosis and management of cow’s milk allergy. Clin Exp Allergy. 2014;44(5):642-672. doi: 10.1111/cea.12302
- Commission Directive 96/4/EC of 16 Februrary 1996. Amending Directive 91/321/EEC on infant formula and follow-on formulae. Official Journal European Communities. 28.02.1996;L 49.
- Turck D. Soy protein for infant feeding: what do we know? Curr Opin Clin Nutr Metab Care. 2007;10(3):360-365. doi: 10.1097/ MCO.0b013e3280fa821b
- Zeiger RS, Sampson HA, Bock SA, et al. Soy allergy in infants and children with IgE associated cow’s milk allergy. J Pediatr. 1999; 134(5):614-622. doi: 10.1016/s0022-3476(99)70249-0
- Zung A, Reifen R, Kerem Z, Zadik Z. Phytoestrogens: the pediatric perspective. J Pediatr Gastroenterol Nutr. 2001;33(2):112-118. doi: 10.1097/00005176-200108000-00003
- Vandenplas Y, Castrellon PG, Rivas R, et al. Safety of soya-based infant formulas in children. Br J Nutr. 2014;111(8):1340-1360. doi: 10.1017/S0007114513003942
- Sinai T, Ben-Avraham S, Guelmann-Mizrahi I, et al. Consumption of soy-based infant formula is not associated with early onset of puberty. Eur J Nutr. 2019;58(2):681-687. doi: 10.1007/s00394-018-1668-3
- Miraglia Del Giudice M, D’Auria E, Peroni D, et al. Flavor, relative palatability and components of cow’s milk hydrolysed formulas and amino acid-based formula. Ital J Pediatr. 2015;41:42. doi: 10.1186/s13052-015-0141-7
- Latcham F, Merino F, Lang A, et al. A consistent pattern of minor immunodeficiency and subtle enteropathy in children with multiple food allergy. J Pediatr. 2003;143(1):39-47. doi: 10.1016/S0022-3476(03)00193-8
- de Boissieu D, Matarazzo P, Dupont C. Allergy to extensively hydrolyzed cow milk proteins in infants: identification and treatment with an amino acid-based formula. J Pediatr. 1997;131(5): 744-747. doi: 10.1016/s0022-3476(97)70104-5
- Antunes J, Borrego LM, Queiroz A, et al. Allergy to extensively hydrolysed formulas. Allergol Immunopathol (Madr). 2009;37(5):272-274. doi: 10.1016/j.aller.2009.05.003
- Fox A, Brown T, Walsh J, et al. An update to the Milk Allergy in Primary Care guideline. Clin Transl Allergy. 2019;9:40. doi: 10.1186/s13601-019-0281-8
- Brandtzaeg P. Food allergy: separating the science from the mythology. Nat Rev Gastroenterol Hepatol. 2010;7(7):380-400. doi: 10.1038/nrgastro.2010.80
- Savilahti EM, Savilahti E. Development of natural tolerance and induced desensitization in cow’s milk allergy. Pediatr Allergy Immunol. 2013;24(2):114-121. doi: 10.1111/pai.12004
- Berni Canani R, Nocerino R, Terrin G, et al. Formula selection for management of children with cow’s milk allergy influences the rate of acquisition of tolerance: a prospective multicenter study. J Pediatr. 2013;163(3):771-777.e1. doi: 10.1016/j.jpeds.2013.03.008
- Traul KA, Driedger A, Ingle DL, Nakhasi D. Review of the toxicologic properties of medium-chain triglycerides. Food and chemical toxicology: an international journal published for the British Industrial Biological Research Association. Food Chem Toxicol. 2000; 38(1):79-98. doi: 10.1016/s0278-6915(99)00106-4
- Heine RG, AlRefaee F, Bachina P, et al. Lactose intolerance and gastrointestinal cow’s milk allergy in infants and children — common misconceptions revisited. World Allergy Organ J. 2017;10(1):41. doi: 10.1186/s40413-017-0173-0
- tos-Rycharska E, Kieraszewicz Z, Czerwionka-Szaflarska M. Medium chain triglycerides (MCT) formulas in paediatric and allergological practice. Prz Gastroenterol. 2016;11(4):226-231. doi: 10.5114/pg.2016.61374
- Zeisel SH, da Costa KA. Choline: an essential nutrient for public health. Nutr Rev. 2009;67(11):615-623. doi: 10.1111/ j.1753-4887.2009.00246.x
- Национальная программа по оптимизации обеспеченности витаминами и минеральными веществами детей России (и использованию витаминных и витаминно-минеральных комплексов и обогащенных продуктов в педиатрической практике). — М.: ПедиатрЪ; 2017. — 152 с. [Natsional’naya programma po opti-mizatsii obespechennosti vitaminami i mineral’nymi veshchestvami detei Rossii (i ispol’zovaniyu vitaminnykh i vitaminnomineral’nykh kompleksov i obogashchennykh produktov v pediatricheskoi prak-tike). Moscow: Pediatr; 2017. 152 p. (In Russ).]
- Aggett P, Leach JL, Rueda R, MacLean WC Jr. Innovation in infant formula development: a reassessment of ribonucleotides in 2002. Nutrition. 2003;19(4):375-384. doi: 10.1016/s0899-9007(02)00999-1
- Lack G. Epidemiologic risks for food allergy. J Allergy Clin Immunol. 2008;121(6):1331-1336. doi: 10.1016/j.jaci.2008.04.032
- Vandenplas Y, De Greef E, Veereman G. Prebiotics in infant formula. Gut Microbes. 2014;5(6):681-687. doi: 10.4161/ 19490976.2014.972237
- Foolad N, Armstrong AW. Prebiotics and probiotics: the prevention and reduction in severity of atopic dermatitis in children. Benef Microbes. 2014;5:151-160. doi: 10.3920/BM2013.0034
