Стеатогепатит у детей с ожирением

Звягин А.А., Фатеева Н.Ю., Чубаров Т.В., Жданова О.А.
Стеатогепатит представляет собой стеатоз печени с воспалением и в некоторых случаях с баллонной дегенерацией гепатоцитов и фиброзом [1]. Стеатогепатит является одной из форм неалкогольной жировой болезни печени (НАЖБП), которая включает широкий спектр состояний: от неалкогольного стеатоза (НАС) — отложения жира в печени более 5% от массы паренхимы без признаков повреждения гепатоцитов до неалкогольного стеатогепатита (НАСГ), прогрессирующего с развитием фиброза, цирроза и у некоторых больных — гепатоцеллюлярной карциномы [1].
Распространенность стеатогепатита в детской популяции, по разным данным, сильно варьирует. Так, в рекомендациях Северо-Американского общества детских гастроэнтерологов, гепатологов и нутрициологов (NASPGHAN) указано, что гипертрансаминаземия встречается у 29-38% детей в возрасте 2-4 лет с ожирением [1]. По данным A. Sahota и соавт. [2], НАСГ был обнаружен у 12% детей с ожирением и избыточной массой тела. В совместных рекомендациях по диагностике, лечению и профилактике ожирения у детей и подростков Российской ассоциации эндокринологов, Российского общества по профилактике неинфекционных заболеваний, Ассоциации детских кардиологов России отмечается, что НАСГ диагностируют у 12-26% детей и подростков с ожирением [3].
Ожирение и избыточную массу тела в настоящее время имеют 25-30% детей школьного возраста [4]. По детям дошкольного возраста практически такая же ситуация. Исследование COSI (Childhood Obesity Surveillance Initiative), проведенное по программе ВОЗ в Москве в 2017-2018 гг., подводя итог динамике массы тела за весь дошкольный период, показало, что среди детей в возрасте 7 лет избыточная масса тела имелась у 27% мальчиков и 22% девочек, а ожирение — у 10 и 6% соответственно [5]. Другое российское исследование, посвященное оценке физического развития детей среднего и школьного возраста [6], также продемонстрировало значимую распространенность в регионах России ожирения и избыточной массы тела в этой возрастной группе. Так, в 11 лет ожирение у мальчиков зафиксировано в 18,6% случаев, у девочек — в 9,2%, а избыток массы тела — в 15,4 и 14,3% соответственно. В 15 лет среди мальчиков ожирение было выявлено в 10% случаев, среди девочек — в 3,6%, избыточная масса — в 11,5 и 10,5% случаев соответственно [6]. Основываясь на этих данных, можно предполагать, что частота НАСГ в детской популяции варьирует от 0,5 до 3%. Следует отметить, что распространенность ожирения, а вместе с ним и НАЖБП, включая НАСГ, растет во всем мире из-за современных негативных тенденций в питании и физической активности детей [7].
Патогенез
Патофизиология молекулярных нарушений при НАСГ сложна и многофакторна. Нарушения метаболического баланса, в результате которых происходит отложение жира в печени, связаны с тремя механизмами (см. рисунок) [8]:
- увеличением количества поступающих в гепатоциты свободных жирных кислот из-за повышенного потребления жира с пищей или количественных/ качественных нарушений микробиома кишечника;
- увеличением поступления в гепатоциты свободных жирных кислот из неэтерифицированного пула, источником которых является белая жировая ткань;
- активацией в печени липогенеза de novo, причина которой связана с избыточным количеством углеводов и/или гиперинсулинемией ввиду невосприимчивости жировой ткани к инсулину.
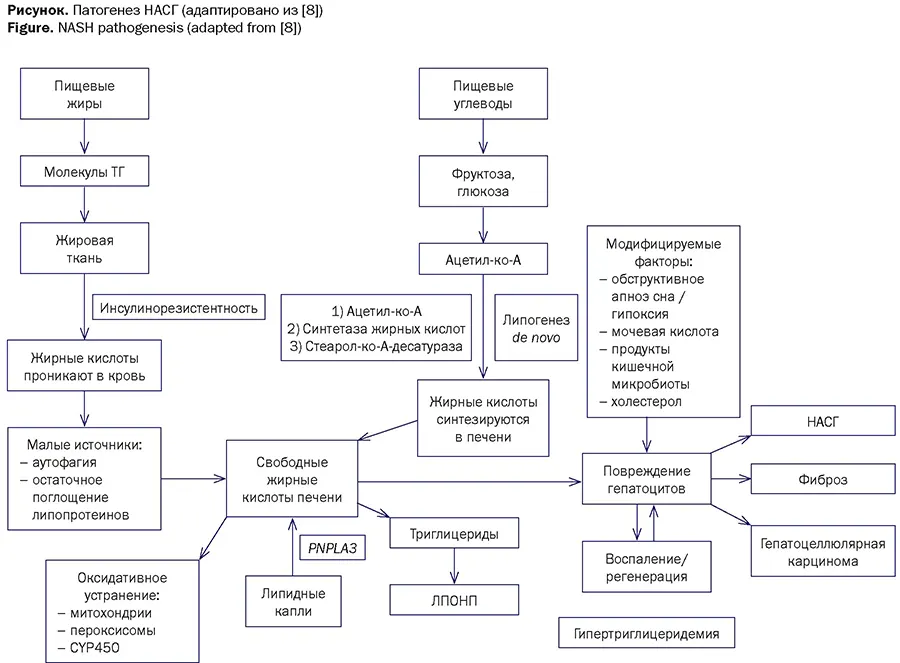
Примечание. ЛПОНП — липопротеины очень низкой плотности, НАСГ — неалкогольный стеатогепатит, ТГ — триглицериды, PNPLA3 — ген, кодирующий липазу триацилглицерина.
Note. ЛПОНП — very low-density lipoproteins, НАСГ — non-alcoholic steatohepatitis, ТГ — triglycerides, PNPLA3 — gene encoding triacylglycerol lipase.
Накопление в гепатоцитах триглицеридов и свободных жирных кислот происходит в том случае, когда указанные процессы не компенсируются повышенной выработкой в печени липопротеинов очень низкой плотности [8]. Принято считать, что липотоксичность связана с накоплением в гепатоцитах не триглицеридов, а свободных жирных кислот и их метаболитов [8], ведущих к оксидативному стрессу и последующему повреждению внутриклеточных структур (митохондрий, эндоплазматического ретикулума). Эти изменения вызывают каскад реакций, включая высвобождение гепатоцитами активных форм кислорода, IL-6, -10, -18, TNF-α, IFN-γ и привлечение иммунных клеток (плазмоцитов, лимфоцитов) [8]. Кульминацией этих процессов является повреждение гепатоцитов, прогрессирующее воспаление, программируемая гибель клеток (апоптоз) и фиброзное ремоделирование печени посредством отложения коллагена из активированных звездчатых клеток [8].
В последние годы патогенез НАС и НАСГ связывают с изменениями в микробиоте кишечника, которые приводят к бактериальной транслокации, особенно высокоиммунореактивного грамотрицательного компонента клеточной стенки, называемого липополисахаридом (ЛПС), в системное кровообращение, что еще больше усиливает воспалительный процесс путем активации макрофагов и клеток Купфера. Установлено, что изменение микробиоты кишечника у пациентов с НАЖБП связано с генами K01470, K01961, K07258 и проявляется нарушением путей метаболизма аргинина и пролина, синтеза жирных кислот и биосинтеза и метаболизма полисахаридов [9]. Кроме того, эти три функциональных гена были связаны со значимыми нарушениями микробиома кишечника — снижением количества Bacteroides, Bifidobacterium, Ruminococcus и увеличением Prevotella, что показывает возможность влияния нарушений кишечной флоры на изменение метаболизма липидов за счет дифференциальной экспрессии генов, способствующего патогенезу НАЖБП, в т.ч. НАСГ [9].
Перекармливание детей в грудном возрасте ведет к избыточной массе тела в последующем, что, в свою очередь, может предопределить развитие НАЖБП. Экспериментальное исследование на крысах показало, что избыточное кормление особей в возрасте 3-13 нед вызывало избыток глюкокортикоидов посредством активации фермента 11β-HSD1 (11β-гидроксистероиддегидрогеназа 1-го типа) в печени, который, в свою очередь, активировал печеночный липогенез de novo через глюкокортикоидные рецепторы, что приводило к накоплению липидов в печени, увеличивало риск НАЖБП в зрелом возрасте [10].
В исследованиях большое значение отводится анализу генетической предрасположенности к возникновению ожирения и НАСГ. Значимая роль в возникновении НАСГ принадлежит гену PNPLA3, кодирующему белок липазу триацилглицерина, который участвует в метаболизме липидов и способствует накоплению липидных молекул в гепатоцитах, установлена ассоциация полиморфизма PNPLA3 с повышенным уровнем АлАТ и более частой встречаемостью у детей с ожирением разного возраста с метаболическим синдромом [11]. Ген TM6SF2, кодирующий трансмембранный белок 6 суперсемейства 2, способствует формированию избыточного количества липопротеинов очень низкой плотности в гепатоцитах, что приводит к накоплению триглицеридов в клетках печени [12]. Также отмечена роль гена AKR1D1, кодирующего стероидную 5β-редуктазу, варианты которого увеличивают накопление триглицеридов в гепатоцитах, чувствительность к инсулину и синтез гликогена за счет повышения липогенеза de novo и снижения β-окисления, активируя воспаление гепатоцитов [13]. Отмечается связь между вариантом гена MTHFR 677CT и уровнем гомоцистеина как компонента оксидативного стресса у пациентов с НАЖБП [14]. Установлены и другие гены, имеющие значение при развитии НАСГ и прогрессировании в стеатофиброз [12].
Изучается роль витамина D в патогенезе НАЖБП. В работе M. Kong и соавт. было продемонстрировано, что диета с высоким содержанием жиров и дефицитом витамина D препятствует энтерогепатической циркуляции желчных кислот, приводя к НАСГ [15]. Показано также, что недостаточность витамина D может усиливать дисфункцию жировой ткани и, в частности, вызывать повышение продукции цитокинов (TNF-α, IL-1β, IL-6), что способствует прогрессированию НАЖБП [16]. Было показано, что у детей с НАЖБП значимый фиброз печени (стадия ≥ 2 по УЗИ) был выявлен у 29% с недостаточностью витамина D (концентрация 25(OH)D в сыворотке крови — 21-30 нг/мл) и у 17% с нормальным уровнем витамина [17].
Диагностика
Лабораторная диагностика
Диагностика НАСГ у детей, как и НАЖБП в целом, не представляет сложностей. Согласно рекомендациям ESPGHAN (2012), план обследования и дифференциальной диагностики у детей с НАЖБП должен включать следующие лабораторные исследования [4]:
- клинический анализ крови, определение уровня гликемии, инсулина натощак, мочевины, электролитов, коагулограмма;
- анализ биохимических показателей состояния печени — аспартатаминотрансфераза (АсАТ), аланинаминотрансфераза (АлАТ), отношение АлАТ/АсАТ, γ-глютамилтранспептидаза (ГГТП), билирубин общий и его фракции;
- липидограмма — холестерин, триглицериды, липопротеины высокой плотности (ЛПВП), липопротеины низкой плотности (ЛПНП);
- пероральный глюкозотолерантный тест, гликированный гемоглобин (HbA1c);
- определение индексов HOMA-IR и ISI-gly как показателей резистентности к инсулину;
- оценка функционального состояния щитовидной железы;
- исключение болезни Вильсона — концентрация церулоплазмина, меди в сыворотке крови, экскреция меди с мочой за сутки;
- исключение муковисцидоза — потовая проба;
- исключение целиакии — антитела (IgA) к тканевой трансглутаминазе, общий IgA;
- другие тесты в соответствии с анамнезом — исключение вирусных гепатитов, аутоиммунных заболеваний печени (печеночные аутоантитела), сывороточные иммуноглобулины.
Рекомендуемый в настоящее время тест для скрининга стеатогепатита — определение активности АлАТ [1, 18]. НАСГ чаще обнаруживают у детей с АлАТ ≥ 80 Ед/л по сравнению с детьми с активностью фермента < 80 Ед/л (у 41 и 21% соответственно). При показателе АлАТ > 80 Ед/л на протяжении ≥ 3 мес необходимо провести оценку клинических данных, поскольку такое повышение активности фермента может указывать на имеющееся повреждение гепатоцитов [18]. При отсутствии факторов риска развития НАЖБП (чрезмерное увеличение массы тела, сахарный диабет 2-го типа, обструктивное апноэ во сне) активность АлАТ рекомендовано исследовать каждые 2-3 года [1]. При наличии указанных факторов риска рекомендуется повторение исследования АлАТ в сыворотке крови [1], периодичность повторного анализа в международных рекомендация не определена, вопрос решается индивидуально.
В ряде исследований было показано, что сверхэкспрессия HIF-2a (фактора, индуцируемого гипоксией) [19], висфатина [20, 21], повышение концентрации С-реактивного белка, аполипопротеина А1, гаптоглобина и α2-макроглобулина [22], фактора роста фибробластов 21 [23], адипонектина и рецептора адипонектина 2 [24] ассоциированы с прогрессированием НАЖБП, подавлением β-окисления жирных кислот и индукцией липогенеза в печени [19]. Кроме того, вышеперечисленные факторы обладают выраженной липотоксичностью и запускают цикл прогрессирующего повреждения органелл гепатоцитов, приводящий к их апоптозу и асептическому воспалению [25]. Воспаление жировой ткани и дисбактериоз кишечника обеспечивают субстраты для образования активных форм кислорода, усиливающих воспаление [25]. И, наконец, прогрессирование от простого стеатоза до НАСГ обеспечивает дисбаланс между провоспалительными (TNFα-, резистин, IL-6) и противовоспалительными (адипонектин) цитокинами с доминированием эффектов первых [26].
Гистологическое исследование
Биопсия печени — исследование для диагностики и дифференциальной диагностики стеатоза и стеатогепатита и исключения других заболеваний, рекомендованное ESPGHAN и называемое в консенсусе эталонным [4]. Гистологическими признаками НАСГ являются наличие гепатоцитов с жировыми макровезикулами и смещенным к мембране ядром, изменение гепатоцитов по типу баллонной дегенерации, смешанное воспаление в печеночных дольках [4]. Также при исследовании биоптатов печени могут отмечаться, но не являются обязательными при морфологической диагностике НАСГ перисинусоидально-перицеллюлярный фиброз наряду с мегамитохондриями, ацидофильные тела и гликогенизированные ядра. Биопсия печени не может широко применяться из-за инвазивности и угрозы развития осложнений как у взрослых, так и у детей. Конкретных рекомендаций по отбору детей для этого исследования в международных рекомендациях нет, по сути, оно показано всем больным с НАСГ. Высокая стоимость (по нашим оценкам, в России — 12 000-20 000 руб.) этого метода диагностики также является проблемой [1].
Инструментальная визуализация
В инструментальной диагностике НАЖБП ESPGHAN (2012) рекомендует использовать ультрасонографию, компьютерную и магнитно-резонансную томографию, фибросканирование печени [4], которые целесообразны и при НАСГ, прежде всего для выявления имеющегося вместе с воспалением фиброза печеночной ткани.
Ультразвуковая диагностика (УЗИ) является методом качественной оценки состояния ткани печени, доступным в большинстве лечебных учреждений. Чувствительность УЗИ в отношении выявления изменений печени при НАЖБП составляет 60-96%, специфичность — 84-100% [4]. Не вызывает сомнений, что результаты УЗИ-диагностики зависят от аппарата и навыков врача, выполняющего исследование. Однако данный метод является достаточно быстрым для диагностики поражения печени — длительность проведения исследования составляет около 20 мин. Порог выявления изменений паренхимы печени при УЗИ у пациентов с НАЖБП — наличие жировой инфильтрации ≥ 20% гепатоцитов [4]. Для оценки степени НАЖБП предложен ультразвуковой индекс ожирения печени — новая система оценки в диапазоне значений 2-8 баллов, основанная на учете таких показателей, как интенсивность УЗИ-сигналов печени относительно почек, ослабление УЗИ-сигнала в забрюшинном пространстве, нечеткости визуализации сосудов, затруднение визуализации стенки желчного пузыря, диафрагмы, обнаружение очаговых изменений в печени [27]. В исследовании H.K. Liu и соавт. показатель ультразвукового индекса ожирения печени ≥ 6 баллов являлся предиктором стеатогепатита у детей с НАЖБП, и авторы предложили использовать этот показатель для прогнозирования стеатогепатита у детей с НАЖБП без обязательной биопсии печени [28].
Компьютерная томография (КТ) позволяет оценить наличие и степень жировой инфильтрации печени, т.е. провести качественный и количественный анализ состояния печеночной ткани. Чувствительность КТ в отношении выявления изменений печени при НАЖБП составляет 82%, специфичность — 100% [4]. При этом КТ позволяет идентифицировать стеатоз при жировой инфильтрации свыше 30% гепатоцитов [4]. КТ доступна и проводится достаточно быстро — требуется не более 5 мин для получения результата. Вместе с тем следует подчеркнуть, что данный метод связан с ионизирующим излучением, что ограничивает его применение у детей.
Магнитно-резонансная томография (МРТ) также позволяет качественно и количественно оценить жировую инфильтрацию печени. Метод является широкодоступным, но пока еще относительно дорогим [4]. Оценка плотности печени происходит в режиме Т1. Чувствительность метода в отношении выявления изменений печени при НАЖБП составляет 100%, специфичность — 90,4% [4]. Для проведения МРТ необходимо 10-15 мин. Вместе с тем МРТ имеет ряд противопоказаний: наличие в теле пациента металлических элементов, а также избыточная масса тела, на которую не рассчитан укладочный стол. Нужно отметить, что оценка с помощью МРТ возможна при жировой инфильтрации печени 1-й степени — 5-30% гепатоцитов [4].
1H-MR spectroscopy — магнитно-резонансная спектроскопия — метод, позволяющий качественно и количественно оценить состояние паренхимы печени. Метод отличается высокой стоимостью (от 5000 до 15 000 руб.). Исследование проводится в режиме T2 — жиронасыщенная спектроскопия, измерение площади при пике липидного резонанса. Чувствительность метода составляет 87-100%, диагностическая точность — 80-85% [4].
Эластография печени позволяет оценить жировую инфильтрацию печени, обнаружить фиброзные изменения. Метод основан на измерении плотности печеночной ткани посредством распространения сдвиговой волны. Чувствительность метода для случаев НАЖБП составляет 81-85%, специфичность — 74-78% [4]. Продолжительность эластографии печени составляет не более 20 мин. Исследование является неинвазивным, быстрым, воспроизводимым [15]. Несмотря на достоинства, в лечебных учреждениях этот метод широко не применяется ввиду дефицита соответствующей аппаратуры и не включен в российские стандарты обследования детей. Y.D. Kwon и соавт., обследовав детей с ожирением (в т.ч. с НАС и НАСГ) обнаружили фиброз (жесткость печени > 5,5 кПа) у 30 (51%) из 59 детей, тогда как в группе детей без ожирения случаи фиброза обнаружены не были. Показатель жесткости печени коррелировал с активностью АсАТ (r = 0,525), АлАТ (r = 0,594), инсулино-резистентностью (HOMA-IR, r = 0,400) и индексом отношения АсАТ к числу тромбоцитов (r = 0,480) [29].
Расчетные индексы
В настоящее время для оценки наличия и гистологической активности фиброза, воспаления, стеатоза и других процессов при НАЖБП и НАСГ используют расчетные индексы, учитывающие значения биохимических показателей и минимальные анамнестические данные. Эти индексы продемонстрировали свою информативность, простоту в использовании, но их недостатком является высокая стоимость (11 000-20 000 руб.). Отметим также, что не удалось обнаружить информации о показателях диагностической точности этих тестов (чувствительности, специфичности).
Шкала NAS (NAFLD activity score, шкала активности НАЖБП) предложена для полуколичественной оценки стеатоза (в %), лобулярного воспаления, баллонной дистрофии, а также стадии фиброза. Таким образом, дается характеристика степени тяжести и стадии НАЖБП [4, 30]. Для каждого пункта шкалы существует оценка от 0 до 2 баллов. Суммарная оценка ≥ 5 баллов позволяет поставить диагноз НАСГ [4, 31].
Тест «ФиброМакс» учитывает значения 10 показателей биохимического анализа крови: АлАТ, АсАТ, ГГТП, общий билирубин, α2-макроглобулин, аполипопротеин А1, гаптоглобин, общий холестерин, триглицериды, глюкоза. Математические алгоритмы (всего 5) на основании значений указанных показателей определяют такие характеристики состояния печени, как:
- тяжесть фиброза с определением стадии (F0-F4) в соответствии с международной системой METAVIR (ФиброТест);
- активность некротического и воспалительного процессов с определением степени (А0-А3) — также в соответствии с системой METAVIR (АктиТест);
- наличие и степень выраженности стеатоза печени (СтеатоТест);
- наличие алкогольного стеатогепатита у лиц, злоупотребляющих алкоголем (ЭшТест);
- наличие НАСГ у пациентов с избыточной массой тела, инсулинорезистентностью, гиперлипидемией, а также у больных сахарным диабетом (Нэш-Тест, от англ. NASH — non-alcoholic steatohepatitis) [31].
Проводится и сокращенный вариант теста ФиброМакс под названием ФиброТест, когда применяют только 2 расчетных алгоритма по результатам математической обработки 6 биохимических показателей крови: α2-макроглобулин, гаптоглобин, аполипопротеин А1, ГГТП, общий билирубин, АлАТ. При этом оценка дается только по двум шкалам — степени тяжести фиброза печени и активности некровоспалительного процесса в печени.
Терапия
Изменение образа жизни
В настоящее время основными способами лечения детей с НАСГ, как и с другими формами НАЖБП, являются гипокалорийная диета и физическая активность, нацеленные на коррекцию избыточной массы тела или ожирения. Модификация образа жизни с изменением рациона питания и повышением физической активности рекомендуется в качестве первой линии терапии для всех детей с НАЖБП/НАСГ [1]. Также показано ограничение потребления сладких напитков [1]. В соответствии с рекомендациями NASPGHAN необходимо увеличить физическую активность детей до средней или высокой интенсивности и ограничивать время, проводимое за экраном гаджетов, до 2 ч/сут [1]. Российская ассоциация эндокринологов советует при лечении детей с ожирением следовать аналогичным рекомендациям [3]. Специальные российские рекомендации по лечению детей с НАЖБП и НАСГ не разработаны.
Медикаментозное лечение
С самого начала важно подчеркнуть, что NASPGHAN (2017) [1] не рекомендует использовать для лечения пациентов с НАЖБП/НАСГ какие-либо лекарственные средства и пищевые добавки.
В экспериментальных исследованиях на мышах с НАЖБП было показано, что метформин купирует гепатомегалию, стеатоз и нарушения активности аминотрансферазы [32], что подтверждалось результатами и некоторых клинических исследований [33]. Однако в последующем в более строгих клинических исследованиях уменьшения гистологических изменений печени у пациентов с НАЖБП на фоне терапии метформином выявлено не было [34].
Согласно результатам рандомизированного двойного слепого плацебоконтролируемого исследования, лечение высокими дозами (28-35 мг/кг в сутки) урсодезоксихолевой кислоты (УДХК) в течение 12 мес снижает активность аминотрансфераз, концентрацию сывороточных маркеров фиброза у взрослых пациентов с гистологически подтвержденным НАСГ [35]. В российском наблюдательном исследовании отмечено, что после терапии УДХК в дозе 12-15 мг/кг нормализация активности печеночных ферментов достигнута у 96% детей с НАСГ [36]. В рандомизированном контролируемом исследовании было установлено, что терапия УДХК и витамином Е на протяжении 2 лет снижала активность АсАТ и АлАТ и выраженность стеатоза печени у пациентов с НАСГ [37]. В экспериментальных исследованиях на моделях животных, кроме того, показано, что препараты УДХК оказывают, помимо прочего, антифибротический и антиапоптотический эффекты [38]. Согласно утвержденным Минздравом России инструкциям по применению препаратов УДХК, они показаны в т.ч. и пациентам с НАСГ и не имеют среди противопоказаний детский возраст, а значит, могут применяться у детей в дозе 10-15 мг/кг в сутки в течение 6-12 мес и более. Однако в качественных клинических исследованиях эффективность и безопасность УДХК у детей с НАЖБП/НАСГ до настоящего времени не изучали.
В официальных инструкциях Государственного реестра лекарственных средств РФ у некоторых препаратов эссенциальных фосфолипидов или их комбинации с другими компонентами гепатопротективного действия в показаниях указана жировая дистрофия и дегенерация печени, а в противопоказаниях — детский возраст до 3 или до 12 лет. Следовательно, возможно их использование в терапии НАСГ у детей соответствующего возраста. Вместе с тем следует отметить, что качественных контролируемых исследований эффективности и безопасности эссенциальных фосфолипидов при стеатогепатите и стеатозе печени у детей не проводили.
Имеются данные по использованию в терапии больных со стеатозом и стеатогепатитом различных пищевых добавок. В рандомизированном исследовании у детей была показана эффективность комбинации аскорбиновой кислоты + витамина Е / ω3-полиненасыщенных жирных кислот [39], в рандомизированных двойных слепых плацебоконтролируемых исследованиях у взрослых — δ-токотриенола [40], у детей — пробиотика Lactobacillus rhamnosus GG [41], синбиотиков [42]. Эффективность Lactobacillus rhamnosus GG подтверждена также в российском наблюдательном исследовании с участием детей [43]. Применение ω3-полиненасыщенных жирных кислот у детей также приводило к купированию проявлений НАСГ, что подробно описывается в обзоре литературы S. Spahis и соавт. [44]. Использование указанных пищевых добавок в различной степени снижало активность АлАТ, индекс массы тела и/или число гепатоцитов, вовлеченных в жировую инфильтрацию.
ЗАКЛЮЧЕНИЕ
НАСГ, как и другие формы НАЖБП, является распространенной патологией детского возраста, что связано с неуклонным ростом в популяции числа детей с избыточной массой тела и ожирением. К сожалению, из-за современных тенденций питания и малоподвижного образа жизни в ближайшей перспективе снижения заболеваемости НАЖБП ожидать не приходится. Точные причины и патогенетические механизмы прогрессирования стеатогепатоза в стеатогепатит окончательно не ясны. Однако не вызывает сомнений, что рецидивирующие или персистирующие некротические и воспалительные изменения в печени со временем приведут к фиброзу. Выявление поражения печени у детей с избыточной массой тела или ожирением должно стать для родителей, самого ребенка, врачей-педиатров и других специалистов дополнительным мотивирующим фактором по активизации усилий для изменения образа жизни пациента. Это основной и эффективный способ лечения НАСГ и в целом НАЖБП, а назначение гепатопротекторов, антиоксидантов длительными курсами служит дополнением, которое может замедлить прогрессирование патологического процесса в печени.
СПИСОК ЛИТЕРАТУРЫ / REFERENCES
- Vos MB, Abrams SH, Barlow SE, et al. NASPGHAN Clinical Practice Guideline for the Diagnosis and Treatment of Nonalcoholic Fatty Liver Disease in Children: Recommendations from the Expert Committee on NAFLD (ECON) and the North American Society of Pediatric Gastroenterology, Hepatology and Nutrition (NASPGHAN). J Pediatr Gastroenterol Nutr. 2017;64(2):319-334. doi: 10.1097/ MPG.0000000000001482
- Sahota AK, Shapiro WL, Newton KP, et al. Incidence of Nonalcoholic Fatty Liver Disease in Children: 2009-2018. Pediatrics. 2020;146(6):e20200771. doi: 10.1542/peds.2020-0771
- Рекомендации по диагностике, лечению и профилактике ожирения у детей и подростков. — М.: Практика; 2015. — С. 19. [Rekomendatsii po diagnostike, lecheniyu i profilaktike ozhireniya u detei i podrostkov. Moscow: Praktika; 2015. p. 19. (In Russ).]
- Vajro P, Lenta S, Socha P, et al. Diagnosis of nonalcoholic fatty liver disease in children and adolescents: position paper of the ESPGHAN Hepatology Committee. J Pediatr Gastroenterol Nutr. 2012;54(5):700-713. doi: 10.1097/MPG.0b013e318252a13f
- Rito AI, Buoncristiano M, Spinelli A, et al. Association between Characteristics at Birth, Breastfeeding and Obesity in 22 Countries: The WHO European Childhood Obesity Surveillance Initiative — COSI 2015/2017. Obes Facts. 2019;12(2):226-243. doi: 10.1159/000500425
- Намазова-Баранова Л.С., Елецкая К.А., Кайтукова Е.В., Макарова С.Г. Оценка физического развития детей среднего и старшего школьного возраста: анализ результатов одномоментного исследования // Педиатрическая фармакология. — 2018. — Т. 15. — № 4. — С. 333-342. [Namazova-Baranova LS, Yeletskaya KA, Kaytukova EV, Makarova SG. Evaluation of the Physical Development of Children of Secondary School Age: an Analysis of the Results of a Cross-Sectional Study. Pediatricheskaya farmakologiya — Pediatric pharmacology. 2018;15(4):333-342. (In Russ).] doi: 10.15690/pf.v15i4.1948
- Mapping the health system response to childhood obesity in the WHO European Region. An overview and country perspectives. Copenhagen: World Health Organization Regional Office for Europe; 2019. 4 p. Available online: https://www.euro.who.int/__data/ assets/pdf_file/0019/401176/Childhood-obesity-web.pdf. Accessed on June 23, 2021.
- Neuschwander-Tetri BA. Non-alcoholic fatty liver disease. BMC Med. 2017;15(1):45. doi: 10.1186/s12916-017-0806-8
- Ling JR, Zhang YJ, Zhang ZH, et. al. Specific changes of intestinal microflora in children with nonalcoholic fatty liver disease. Zhonghua Er Ke Za Zhi. 2018;56(11):850-855. doi: 10.3760/ cma.j.issn.0578-1310.2018.11.011
- Yang F, Dai Y, Min C, Li X. Neonatal overfeeding induced glucocorticoid overexposure accelerates hepatic lipogenesis in male rats. Nutr Metab (Lond). 2018;15:30 doi: 10.1186/ s12986-018-0272-0
- Flisiak-Jackiewicz M, Lebensztejn DM. Update on pathogenesis, diagnostics and therapy of nonalcoholic fatty liver disease in children. Clin Exp Hepatol. 2019;5(1):11-21. doi: 10.5114/ ceh.2019.83152
- Богомолов П.О., Кокина К.Ю., Майоров А.Ю., Мишина Е.Е. Генетические аспекты неалкогольной жировой болезни печени // Вопросы современной педиатрии. — 2018. — Т. 17. — № 6. — С. 442-448. [Bogomolov PO, Kokina KYu, Mayorov AYu, Mishina EE. Genetic Aspects of Non-Alcoholic Fatty Liver Disease. Voprosy sovremennoi pediatrii — Current Pediatrics. 2018;17(6):442-448. (In Russ).] doi: 10.15690/vsp.v17i6.1974
- Nikolaou N, Gathercole L, Marchand L, et al. AKR1D1 is a novel regulator of metabolic phenotype in human hepatocytes and is dysregulated in non-alcoholic fatty liver disease. Metabolism. 2019;99:67-80. doi: 10.1016/j.metabol.2019.153947
- Wang X, Zhou Y, Zhang M, et al. The methylenetetrahydrofolate reductase genotype 677CT and non-alcoholic fatty liver disease have a synergistic effect on the increasing homocysteine levels in subjects from Chongqing, China. Genes Dis. 2018;6(1):88-95. doi: 10.1016/j.gendis.2018.07.003
- Kong M, Longdong Zhu, Bai L, et al. Vitamin D deficiency promotes nonalcoholic steatohepatitis through impaired enterohepatic circulation in animal model. Am J Physiol Gastrointest Liver Physiol. 2014;307(9):G883-G893. doi: 10.1152/ajpgi.00427.2013
- Cimini FA, Barchetta I, Carotti S, et al. Relationship between adipose tissue dysfunction, vitamin D deficiency and the pathogenesis of non-alcoholic fatty liver disease. World J Gastroenterol. 2017;23(19):3407-3417. doi: 10.3748/wjg.v23.i19.3407
- Yodoshi, T, Orkin S, Arce-Clachar AC, et al. Vitamin D deficiency: prevalence and association with liver disease severity in pediatric nonalcoholic fatty liver disease. Eur J Clin Nutr. 2020;74(3): 427-435. doi: 10.1038/s41430-019-0493-y
- Schwimmer JB, Newton KP, Awai HI, et al. Paediatric gastroenterology evaluation of overweight and obese children referred from primary care for suspected non-alcoholic fatty liver disease. Aliment Pharmacol Ther. 2013;38(10):1267-1277. doi: 10.1111/apt.12518
- Chen J, Chen J, Fu H, et al. Hypoxia exacerbates non-alcoholic fatty liver disease via HIF-2a/PPARa pathway. Am J Physiol Endocrinol Metab. 2019;317(4):E710-E722. doi: 10.1152/ ajpendo.00052.2019
- Elkabany ZA, Hamza RT, Ismail EAR, et al. Serum visfatin level as a noninvasive marker for nonalcoholic fatty liver disease in children and adolescents with obesity: relation to transient elastography with controlled attenuation parameter. Eur J Gastroenterol Hepatol. 2020;32(8):1008-1016. doi: 10.1097/MEG.0000000000001608
- Wen H, Wang HJ, Dong B, Ma J. Relationship between serum visfatin level and children and adolescent obesity and nonalcoholic fatty liver disease. Zhonghua Liu Xing Bing Xue Za Zhi. 2012;33(3):269-272.
- Cura-Esquivel I, Cordero-Perez P Torres-Gonzalez L, Munoz-Espinosa LE. Acute phase markers in obese children and adolescents with metabolic disorders. Arch Argent Pediatr. 2018;116(4): 275-282. doi: 10.5546/aap.2018.eng.275
- Hua M, Huang J-L, Hu C-C, et al. Including Fibroblast Growth Factor-21 in Combined Biomarker Panels Improves Predictions of Liver Steatosis Severity in Children. Front Pediatr. 2019;7:420. doi: 10.3389/fped.2019.00420
- Aksoy GK, Artan R, Aksoy C, et al. Role of Soluble Adiponectin Receptor 2 in Non-Alcoholic Fatty Liver Disease in Children. Pediatr Gastroenterol Hepatol Nutr. 2019;22(5):470-478. doi: 10.5223/ pghn.2019.22.5.470
- Mann JP, Raponi M, Nobili V. Clinical implications of understanding the association between oxidative stress and pediatric NAFLD. Expert Rev Gastroenterol Hepatol. 2017;11(4):371-382. doi: 10.1080/17474124.2017.1291340
- Tilg H, Hotamisligil GS. Nonalcoholic fatty liver disease: cytokine-adipokine interplay and regulation of insulin resistance. Gastroenterology. 2006;131(3):934-945. doi: 10.1053/j.gastro.2006.05.054
- Ballestri S, Lonardo A, Romagnoli D, et al. Ultrasonographic fatty liver indicator, a novel score which rules out NASH and is correlated with metabolic parameters in NAFLD. Liver Int. 2012;32(8): 1242-1252. doi: 10.1111/j.1478-3231.2012.02804.x
- Liu H, Yang MC, Su YT, et al. Novel Ultrasonographic Fatty Liver Indicator Can Predict Hepatitis in Children With Non-alcoholic Fatty Liver Disease. Front Pediatr. 2019;6:416. doi: 10.3389/ fped.2018.00416
- Kwon YD, Ko KO, Lim JW, et al. Usefulness of Transient Elastography for Non-Invasive Diagnosis of Liver Fibrosis in Pediatric Non-Alcoholic Steatohepatitis. J Korean Med Sci. 2019;34(23):e165. doi: 10.3346/jkms.2019.34.e165
- Bedossa P. Current histological classification of NAFLD: strength and limitations. Hepatol Int. 2013;7(2):765-770. doi: 10.1007/ s12072-013-9446-z
- Poynard T, Lassailly G, Diaz E, et al. Performance of biomarkers FibroTest, ActiTest, SteatoTest, and NashTest in patients with severe obesity: meta analysis of individual patient data. PLoS One. 2012;7(3):e30325. doi: 10.1371/journal.pone.0030325
- Lin HZ, Yang SQ, Chuckaree C, et al. Metformin reverses fatty liver disease in obese, leptin-deficient mice. Nat Med. 2000;6(9): 998-1003. doi: 10.1038/79697
- Bugianesi E, Gentilcore E, Manini R, et al. A randomized controlled trial of metformin versus vitamin E or prescriptive diet in nonalcoholic fatty liver disease. Am J Gastroenterol. 2005;100(5):1082-1090. doi: 10.1111/j.1572-0241.2005.41583.x
- Lavine JE, Schwimmer JB, Van Natta ML, et al. Effect of vitamin E or metformin for treatment of nonalcoholic fatty liver disease in children and adolescents: the TONIC randomized controlled trial. JAMA. 2011;305(16):1659-1668. doi: 10.1001/ jama.2011.520
- Ratziu V, de Ledinghen V, Oberti F, et al. A randomized controlled trial of high-dose ursodesoxycholic acid for nonalcoholic steatohepatitis. J Hepatol. 2011;54(5):1011-1019. doi: 10.1016/ j.jhep.2010.08.030
- Рейзис А.Р. Неалкогольная жировая болезнь печени в свете проблемы гепатитов невыясненной этиологии у детей и подростков // РМЖ. — 2019. — № 7. — С. 26-29. [Reyzis AR. Non-alcoholic fatty liver disease — a new view of the hepatitis problem of unknown etiology in children and adolescents. RMJ. 2019;(7):26-29. (In Russ).]
- Dufour JF, Oneta CM, Gonvers JJ, et al. Randomized placebo-controlled trial of ursodeoxycholic acid with vitamin e in nonalcoholic steatohepatitis. Clin Gastroenterol Hepatol. 2006;4(12): 1537-1543. doi: 10.1016/j.cgh.2006.09.025
- Казюлин А.Н. Место урсодезоксихолевой кислоты в терапии неалкогольной жировой болезни печени на разных стадиях заболевания: стеатоз, стеатогепатит, фиброз/цирроз // РМЖ. — 2017. — № 17. — С. 1248-1257. [Kazyulin AN. Place of ursodeoxycholic acid in the therapy of non-alcoholic fatty liver disease at different stages: steatosis, steatohepatitis, fibrosis/ cirrhosis. RMJ. 2017;(17):1248-1257. (In Russ).]
- Caro-Sabido EA, Larrosa-Haro A. Efficacy of dietary intervention and physical activity in children and adolescents with nonalcoholic fatty liver disease associated with obesity: A scoping review. Rev Gastroenterol Mex. 2019;84(2):185-194. doi: 10.1016/ j.rgmx.2019.02.001
- Pervez MA, Khan DA, Ijaz A, Khan S. Effects of Delta-tocotrienol Supplementation on Liver Enzymes, Inflammation, Oxidative stress and Hepatic Steatosis in Patients with Nonalcoholic Fatty Liver Disease. Turk J Gastroenterol. 2018;29(2):170-176. doi: 10.5152/ tjg.2018.17297
- Vajro P, Mandato C, Licenziati MR, et al. Effects of Lactobacillus rhamnosus strain GG in pediatric obesity-related liver disease. J Pediatr Gastroenterol Nutr. 2011;52(6):740-743. doi: 10.1097/ MPG.0b013e31821f9b85
- Eslamparast T, Poustchi H, Zamani F, et al. Synbiotic supplementation in nonalcoholic fatty liver disease: a randomized, double-blind, placebo-controlled pilot study. Am J Clin Nutr. 2014; 99(3):535-542. doi: 10.3945/ajcn.113.068890
- Павловская Е.В., Строкова Т.В., Багаева М.Э. и др. Эффективность пробиотиков в лечении неалкогольной жировой болезни печени у детей с ожирением // РМЖ. — 2020. — № 2. — С. 7-10. [Pavlovskaya EV, Strokova TV, Bagaieva ME, et al. Probiotics efficacy in the treatment of non-alcoholic fatty liver disease in children with obesity. RMJ. 2020;(2):7-10. (In Russ).]
- Spahis S, Alvarez F, Ahmed N, Dubois J, et al. Non-alcoholic fatty liver disease severity and metabolic complications in obese children: impact of omega-3 fatty acids. J Nutr Biochem. 2018;58:28-36. doi: 10.1016/j.jnutbio.2018.03.025
